AVANT-PROPOS : les articles de la rubrique « Ailleurs sur le web » ne représentent pas les positions de notre tendance, mais sont publiés à titre d’information ou pour nourrir les débats d’actualités.
SOURCE : The Conversation
Origine du SARS-CoV-2, survie dans l’environnement, molécules virales ciblées par les traitements en cours de développement, comparaison avec les autres coronavirus pathogènes…
Alors que la seconde vague semble bel et bien là, qu’ont appris les chercheurs au cours des derniers mois ?
D’où provient le coronavirus SARS-CoV-2 ?
Depuis le printemps dernier, plusieurs équipes de recherches tentent d’identifier l’origine du SARS-CoV-2. Tous les scientifiques s’accordent pour dire que la Covid-19 est une maladie zoonotique, autrement dit qu’elle est due à un microbe qui serait passé de l’animal à l’être humain. En l’occurrence, le microbe incriminé est un virus, et plus précisément un coronavirus qui dériverait d’un coronavirus de chauve-souris.
Reste à déterminer précisément comment on est passé d’un virus de chauve-souris à un virus capable d’infecter l’être humain. Il semblerait qu’un autre animal ait pu jouer le rôle d’intermédiaire entre la chauve-souris et notre espèce. La comparaison du matériel génétique du SARS-CoV-2 révèle en effet qu’il pourrait être apparenté à un coronavirus infectant le pangolin.
En compilant l’ensemble des études, trois scénarios possibles se dessinent :
- Le coronavirus initial de la chauve-souris serait passé au pangolin où il aurait pu acquérir la capacité d’infecter l’être humain puis du pangolin à notre espèce humaine ;
- Le passage au pangolin et à l’être humain depuis la chauve-souris aurait été concomitant, et des infections entre pangolin et humain auraient aussi pu se produire ;
- Le passage aurait pu être direct entre la chauve-souris et l’humain.

Reste encore à déterminer précisément où, quand et comment ce virus est passé de son hôte animal à l’humain. Le marché de Wuhan, où les premiers cas ont été détectés, aurait pu jouer un rôle amplificateur alors que le coronavirus circulait déjà. La présence sur un même lieu d’animaux sauvages et domestiques vivants, dans des conditions de promiscuité difficiles à imaginer en Europe, a certainement joué un rôle qui reste à préciser. Les choses sont loin d’être claires pour le moment.
Une autre émergence est-elle possible ?
Depuis l’émergence, au début des années 2000, du SARS-CoV-1 responsable de l’épidémie de SARS (severe acute respiratory syndrome, syndrome respiratoire aigu sévère ou SRAS en français) de 2002-2003, on décrit chaque année de nouveaux coronavirus de chauve-souris. Quelles que soient leur origine géographique et leur espèce, ces animaux sont colonisés par des coronavirus (on parle de colonisation, et non d’infection, car lesdits coronavirus ne rendent pas les chauves-souris malades).
Une équipe a réalisé récemment des prélèvements chez des chauves-souris en Asie. Leurs analyses ont révélé la présence de coronavirus inconnus. Elles révèlent aussi que le génome de ces coronavirus a une grande « malléabilité » : il a tendance à se réarranger au fil des multiplications du virus (on parle de « plasticité » du génome). Ces événements pourraient être à l’origine de nouvelles émergences chez l’être humain.
Le meilleur moyen de s’en prémunir : stopper la chasse et le commerce des animaux sauvages, interdire les marchés où ces derniers côtoient des animaux domestiques…
En quoi le SARS-CoV-2 diffère-t-il des autres coronavirus pathogènes ?
On ne connaissait jusqu’ici que deux coronavirus hautement pathogènes, le SARS-CoV-1 et le MERS-CoV (Middle East respiratory syndrome coronavirus, coronavirus du syndrome respiratoire du Moyen-Orient).
Sur le plan épidémique, le SARS-CoV-1 avait été responsable d’une petite épidémie : entre novembre 2002 et juillet 2003, il a contaminé environ 8 000 personnes et entraîné près de 800 décès. Il est donc caractérisé par un fort taux de létalité (nombre de décès par rapport au nombre de personnes infectées), puisqu’il a tué à peu près 10 % des personnes infectées. Ce virus semble avoir aujourd’hui disparu grâce aux mesures sanitaires mises en place après l’alerte de l’OMS : arrêt de la consommation de civette, l’animal qui semble avoir contaminé l’être humain (même si le virus provient très probablement initialement de la chauve-souris), identification précoce et isolement des personnes infectées. Cependant ce virus circule peut-être encore chez des animaux sauvages.
Contrairement à la pandémie de SARS-CoV-2 qui sévit actuellement, dont on pense que l’évolution dépend notamment de la propagation du virus par des malades atteints de formes d’infection asymptomatiques, au cours de l’épidémie de SARS-CoV-1 aucune infection asymptomatique n’avait été constatée.
Le MERS-CoV circule quant à lui depuis juin 2012 dans la Péninsule arabique. Plus de 2 200 cas avaient été recensés au 5 mai 2018, dont la majorité sur le territoire de l’Arabie saoudite. Environ 36 % des cas confirmés par des analyses de laboratoires se sont traduits par le décès du malade. Ce virus n’a pour l’instant pas diffusé ailleurs, à l’exception de la Corée du Sud, touchée en 2015, suite à l’importation du virus par un voyageur. On ne comprend pas pourquoi il ne se propage pas mieux dans la population humaine.
Le SARS-CoV-2 est-il plus dangereux que le SARS-CoV ou le MERS-CoV ?
Le taux de létalité du SARS-CoV-2 semble moins important que celui des deux autres coronavirus pathogènes. Il est cependant difficile à estimer, notamment parce que de nombreux malades n’ont pas été testés. Selon la Haute Autorité de Santé, en France le taux de létalité global est estimé entre 0,3 et 0,6 % (celui de la grippe saisonnière est estimé à 0,1 %). Cependant ce taux varie fortement en fonction des tranches d’âge considérées, du sexe, des comorbidités… Il augmente fortement après 60 ans : les chiffres espagnols indiquent qu’il passe à 11,6 % pour les hommes de plus de 80 ans (contre 4,6 % pour les femmes de cette tranche d’âge). Des chiffres cohérents avec ceux relevés en Angleterre.
Mais un point est important à souligner : le virus SARS-CoV-2 est responsable de pathologies plus sévères que les deux autres coronavirus hautement pathogènes. Dans leur cas, la formation de caillots n’avait jamais été observée lors des infections, par exemple. En outre, si la « tempête cytokinique » qui se déclenche chez les patients victimes de formes sévères de Covid-19 ressemble à celle qu’on voit au cours de la grippe, elle survient plus tardivement, dure longtemps, et semble difficile à contrôler par l’organisme.
Enfin, on soupçonne le SARS-CoV-2 d’être à l’origine de séquelles chez les malades qui ont été infectés et se sont rétablis, même en cas de formes bénignes : des études ont par exemple révélé chez des patients rétablis le développement d’inflammations du cœur (myocardites) et d’autres anomalies.
Que sait-on de la survie du virus dans l’environnement ?
Des études ont montré que le SARS-CoV-2 était capable de persister sur différentes surfaces. Il peut survivre une journée sur le bois ou le carton d’emballage, de un à deux jours sur le tissu ou le verre, et de trois à quatre jours sur le plastique et l’acier inoxydable. Sur le cuivre, en revanche, il ne tient pas plus de quatre à huit heures.
Des chercheurs de l’Université de médecine de Kyoto ont évalué la stabilité du SARS-CoV-2 sur la peau humaine, en le comparant avec celui de la grippe A. Leurs travaux révèlent que le SARS-CoV-2 survit plus longtemps que le virus de la grippe (9 heures en moyenne contre 1,8 heure). Les deux virus sont plus rapidement inactivés lorsqu’ils sont présents sur la peau que sur d’autres surfaces (acier inoxydable, verre ou plastique) : un traitement par l’éthanol à 80 % pendant 15 secondes est suffisant.
Conclusion des chercheurs : une bonne hygiène des mains est importante pour prévenir la propagation des infections par le SARS-CoV-2…
Antiviraux, vaccins : à quelles parties du virus s’attaquent-ils ?
Les recherches se sont concentrées sur certaines des molécules du SARS-CoV-2, en raison de leur rôle dans l’infection.
La glycoprotéine Spike, située à sa surface, a été particulièrement étudiée. Il s’agit en effet non seulement de la « clé » qui permet à ce coronavirus de pénétrer dans nos cellules, mais aussi de la principale cible des anticorps produits par notre organisme lors de l’infection. C’est sur elle que les vaccins en cours de développement sont focalisés. De ce fait, il est nécessaire de bien la caractériser pour s’assurer d’avoir des vaccins efficaces.
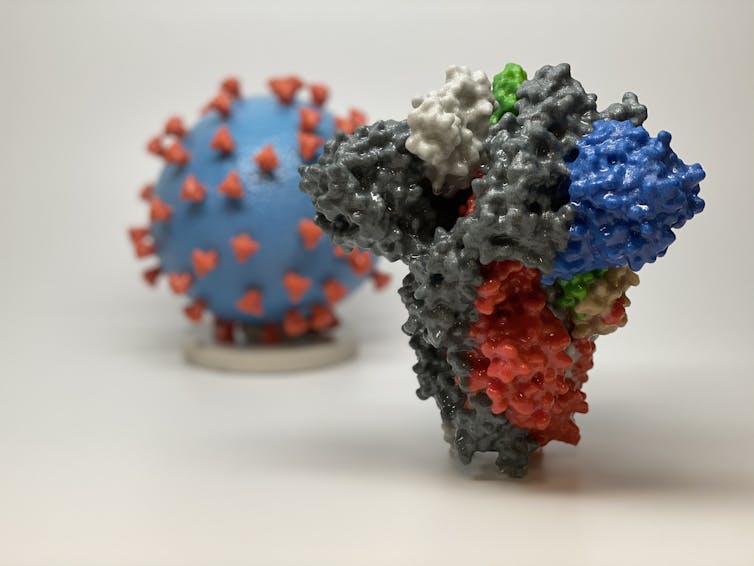
Deux enzymes virales font aussi l’objet de toutes les attentions des scientifiques. Il s’agit de la polymérase RdRp, que le virus utilise pour recopier son matériel génétique, et de la protéase virale, qui lui sert à découper les éléments qui constitueront l’enveloppe protectrice dans laquelle sera emballé ledit matériel. Sans ces enzymes, le virus ne peut plus se reproduire, il ne peut donc infecter l’être humain. Les chercheurs espèrent parvenir à les bloquer en utilisant d’autres molécules. Le problème est que pour y parvenir, il faut connaître parfaitement la structure de ces enzymes, qui sont propres à ce virus. Il faut donc d’abord caractériser, ce qui prend du temps, avant de trouver un moyen de les bloquer.
Une autre approche peut être d’intervenir sur l’entrée du virus dans la cellule humaine. Pour cibler cette étape, il faut bien comprendre les interactions entre la glycoprotéine Spike et le récepteur ACE2, la « serrure » dans laquelle elle s’insère. Une fois accrochée à ACE2, Spike change de forme. Comprendre les tenants et les aboutissants de ces modifications, comment elles permettent l’entrée du virus dans la cellule, comment il est possible de les bloquer sont autant de questions auxquelles devront répondre des travaux de virologie fondamentale !
Au-delà de ces quelques points, il reste encore de nombreuses interrogations sans réponses : quels sont les mécanismes de la réaction inflammatoire observée chez les patients qui développent des maladies sévères ? Quelles sont les molécules virales impliquées ? Pourquoi certains sujets sont asymptomatiques et pas d’autres ? Pourquoi la protection liée à la réaction immunitaire développée après l’infection semble-t-elle de courte durée (on estime actuellement que l’immunité acquise après une infection protège pendant 6 mois à 1 an) ?
On le voit, les scientifiques ne manqueront pas d’occupation dans les mois à venir…
