AVANT-PROPOS : les articles de la rubrique « Ailleurs sur le web » ne représentent pas les positions de notre tendance, mais sont publiés à titre d’information ou pour nourrir les débats d’actualités.
SOURCE : Le Monde
Covid-19 : une pneumonie pas comme les autres
Le traitement des patients Covid-19 présentant une insuffisance respiratoire du fait d’une pneumonie repose sur une assistance respiratoire dans environ 5 % des cas. Dans les formes graves de la maladie, l’atteinte respiratoire peut en effet entraîner un syndrome de détresse respiratoire aiguë (SDRA), pathologie qui est à l’origine de 30%, voire 50 %, de mortalité chez les patients sous respirateur artificiel (ventilation invasive).
Le diagnostic d’un SDRA repose classiquement sur des paramètres bien définis. Les médecins réanimateurs parlent des « critères de Berlin », ville dans laquelle des experts s’étaient réunis en 2012 sous l’égide de l’European Society of Intensive Care Medicine (ESICM) pour définir les paramètres cliniques, ventilatoires, gazométriques (analyse des gaz du sang) et radiologiques permettant d’établir le diagnostic de ce grave syndrome pulmonaire et d’adapter au mieux la prise en charge ventilatoire.
Surprenante tolérance à de faibles taux d’oxygène dans le sang
Il est rapidement apparu que le syndrome de détresse respiratoire aiguë associé au Covid-19 ne ressemble pas à la majorité des SDRA classiques. Alors que dans la moitié des cas de SDRA le poumon perd une partie de ses propriétés élastiques, le poumon reste distensible au stade initial de la pneumonie Covid-19. Il conserve en effet sa capacité à normalement faire varier son volume en fonction de la variation de la pression intrapulmonaire. Les spécialistes parlent de « compliance » préservée. En d’autres termes, le poumon conserve son élasticité. Conséquence : le poumon reste aéré : la quantité d’air intrapulmonaire est normale ou avoisine la valeur normale.
À cette caractéristique non habituellement observée dans la plupart des SDRA, s’ajoute un autre paramètre, clinique cette fois, en rapport avec ce que les spécialistes appellent l’hypoxémie, terme utilisé pour désigner la diminution de la quantité d’oxygène dans le sang. « On constate que de nombreux patients Covid-19 atteints de pneumonie tolèrent étonnamment bien le faible degré d’oxygénation du sang associé à l’atteinte pulmonaire. Cette extrême tolérance à l’hypoxie chez de nombreux patients est une vraie particularité de la pneumonie Covid-19 », déclare Thomas Gille, pneumologue à l’hôpital Avicenne (Bobigny, Seine-Saint-Denis) et chercheur à l’unité Inserm U1272 « Hypoxie et Poumon » (Université Paris 13).
De fait, la pneumonie Covid-19 peut se présenter cliniquement de façon très hétérogène. Pour un même degré d’hypoxémie, certains patients Covid-19 présentent une gêne respiratoire plus ou moins importante, un rythme respiratoire plus ou moins rapide. Ainsi, des patients Covid-19 ayant un très faible degré d’oxygénation sanguine (hypoxémie profonde) peuvent présenter des symptômes très différents. Certains peuvent avoir une respiration normale. Leur hypoxémie est dite « silencieuse », alors que d’autres présentent une gêne respiratoire prononcée. De même, certains patients sont améliorés par la position couchée, d’autres non. Certains réagissent positivement à l’inhalation de monoxyde d’azote [1], gaz entraînant une dilatation des vaisseaux, d’autres non. Enfin, des patients ont une diminution importante de la quantité de dioxyde de carbone (CO2) dans le sang artériel (patients « hypocapniques ») alors que d’autres présentent un taux de dioxyde de carbone normal ou anormalement élevé (patients normo ou « hypercapniques »).
« De nombreux patients Covid-19, pourtant très hypoxémiques, s’expriment normalement, regardent tranquillement la télévision ou encore jouent sur leur smartphone, sans éprouver de difficulté particulière à respirer ou sans présenter une fréquence respiratoire élevée », fait remarquer Damien Barraud, médecin réanimateur au CHR de Metz-Thionville (Grand Est). Pourtant, au vu de leur faible taux d’oxygène dans le sang, les médecins s’attendraient à ce qu’ils aillent mal, autrement dit à ce qu’ils présentent des signes cliniques évocateurs d’un syndrome de détresse respiratoire aiguë (SDRA). « Cela montre qu’il ne faut pas uniquement baser son attitude sur les résultats des gaz du sang. C’est finalement l’état clinique du patient qui compte », souligne Damien Barraud.
Il est probable que cette diversité de présentation clinique pulmonaire chez des patients Covid-19 hospitalisés en urgence tient à l’interaction de nombreux facteurs : la sévérité de l’infection virale, la réponse immunitaire, la réserve physiologique (autrement dit les capacités d’adaptation à l’effort des poumons du patient), la présence de pathologies préexistantes (comorbidités), le délai entre le début des symptômes et l’admission à l’hôpital.
Deux formes cliniques : L et H
Récemment, une équipe allemande a décrit, de façon schématique, deux présentations cliniques différentes de l’atteinte respiratoire associée à l’infection par le SARS-CoV-2. Luciano Gattinoni et ses collègues du département d’anesthésiologie, soins intensifs et médecine d’urgence du centre médical universitaire de Göttingen ont décrit deux présentations cliniques, ou « phénotypes », de l’atteinte respiratoire : le type L (pour Low, faible) et le type H (pourHigh, élevé). La forme clinique L peut s’aggraver et conduire à la forme H.
Le concept de pneumonie de phénotype de type H et de type L a initialement été présenté le 2 avril dernier lors d’un séminaire sur internet (webinar) organisé par l’ESICM, la Société européenne de réanimation, puis le 14 avril dans un article publié dans la revueIntensive Care Medicine.
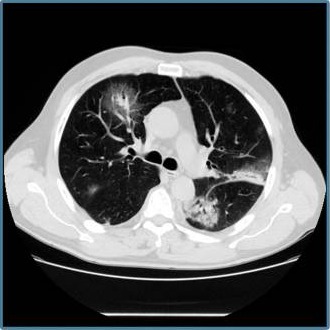
Forme L atypique
Schématiquement, la forme L est caractérisée par une quantité d’air normale dans les poumons (ventilation normale) associée à une perfusion anormalement élevée.
Curieusement, l’irrigation sanguine, qui devrait être compromise, ne l’est pas. En effet, lorsqu’une région reçoit peu d’oxygène via la ventilation, les vaisseaux sanguins aux alentours se contractent. Dans la maladie Covid-19, ce mécanisme, appelé « vasoconstriction pulmonaire hypoxique », ne se produit pas ou insuffisamment [2]. On observe donc une altération de ce mécanisme de régulation de la perfusion.
Dans la forme L, le scanner thoracique montre des images anormales (infiltrats inflammatoires en « verre dépoli »), situés préférentiellement, au moins au début de l’évolution, au niveau de la plèvre (enveloppe des poumons) ou des scissures qui sont les sillons séparant les lobes pulmonaires.
Les patients Covid-19 présentant une forme L répondent classiquement à l’administration d’oxygène, au moins dans un premier temps. Selon les cas, le patient respire au moyen de canules nasales à haut débit fournissant un mélange d’air et d’oxygène humidifié, ou bien d’un simple masque ou d’un masque à haute concentration en oxygène.
Une autre stratégie de ventilation est de mettre le patient sous ventilation en pression positive continue, qui vise à maintenir ouvertes les voies aériennes supérieures pendant toute la durée du cycle respiratoire. L’application de niveaux élevés de pression des voies aériennes a pour objectif d’ouvrir (les spécialistes disent « recruter ») les alvéoles du poumon et ainsi augmenter le nombre d’unités alvéolaires disponibles pour la ventilation.
Ces modalités thérapeutiques comportent néanmoins le risque de retarder une intubation qui pourrait pourtant finir par s’avérer indispensable chez certains patients très dépendants en oxygène.
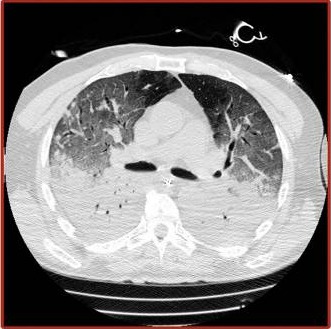
La forme H, plus proche du SDRA « classique »
Le patient présentant le phénotype L peut se stabiliser et ne pas s’aggraver. Il peut également évoluer vers le phénotype H, qui se rapproche alors plus du syndrome de détresse respiratoire aiguë (SDRA) « classique » [3]. Cette forme clinique grave est caractérisée par une diminution de la distensibilité du poumon. Le tissu pulmonaire est alors le siège de lésions qui retentissent fortement sur le niveau d’aération des poumons. De nombreuses zones sont non ventilées car comblées par du liquide (œdème alvéolaire), des cellules ou une substance amorphe. L’air alvéolaire est remplacé par un produit pathologique, ce qui se traduit au scanner par des opacités anormales (condensations alvéolaires).
Ces zones, peu ou pas aérées, continuent cependant à être vascularisées. Les spécialistes parlent alors d’un « effet shunt » intrapulmonaire pour décrire le fait que la ventilation est faible ou absente alors que la perfusion est conservée. Ces patients doivent être étroitement surveillés car leur état clinique peut parfois se détériorer brutalement (avec survenue d’un arrêt cardiaque du fait de l’hypoxémie), ce qui impose de disposer à tout moment du matériel nécessaire pour une intubation en urgence.
Lorsque l’atteinte pulmonaire des patients Covid-19 nécessite une ventilation invasive (respirateur artificiel), le traitement symptomatique du SDRA est la ventilation mécanique. Celle-ci est alors la pierre angulaire de la prise en charge de ces patients, comme dans un SDRA « classique ». Le respirateur exerce alors une pression positive dans les poumons, tant à l’inspiration, pour insuffler un certain volume, qu’à l’expiration lors de laquelle une pression expiratoire positive (PEP) est maintenue.
La ventilation mécanique a pour but principal d’améliorer les échanges gazeux. Il s’agit d’un traitement symptomatique de la défaillance ventilatoire. Il n’a pas de vertu curatrice. Cette stratégie d’assistance ventilatoire permet seulement de passer le cap de la défaillance des poumons. Elle est cependant anti-physiologique et peut donc entrainer des lésions pulmonaires. Afin de limiter ce risque, les réanimateurs appliquent une ventilation dite protectrice.
Les paramètres de la ventilation mécanique pourraient différer selon que le patient présente une atteinte pulmonaire correspondant au phénotype L ou H.
Quelle que soit la forme clinique, il est possible de mettre les patients en décubitus ventral. En effet, dans le SDRA, il a été montré que cette position couchée sur le ventre (face vers le bas), lors de séances prolongées d’au moins 16 heures consécutives, peut présenter un bénéfice statistiquement significatif en termes de mortalité. Le décubitus ventral peut permettre chez les patients Covid-19, de redistribuer la perfusion vers des régions mieux ventilées et d’améliorer les échanges gazeux. Lorsque le patient ne répond pas au décubitus ventral, il est possible d’utiliser l’oxygénation par membrane extracorporelle (ExtraCorporeal Membrane Oxygenation ou ECMO). Cette technique d’assistance cardiorespiratoire, qui élimine le CO2 tout en enrichissant le sang en oxygène, permet de suppléer au travail des poumons malades en assurant les échanges gazeux.
On le voit, même si la classification en deux phénotypes L et H, basée sur des paramètres liés aux mécanismes associés au dysfonctionnement pulmonaire et aux données de l’imagerie, peut apparaître schématique, elle a le mérite de pouvoir conditionner la stratégie de ventilation des patients Covid-19. Les phénotypes L et H correspondent aux deux extrêmes d’un spectre clinique qui comporte des stades intermédiaires.
À tout cela s’ajoutent une inflammation de la paroi interne des vaisseaux sanguins (ce que l’on appelle une atteinte endothéliale) et des troubles de la coagulation à l’origine de la survenue de gros et petits caillots sanguins (macro-thromboses et micro-thromboses) dans le poumon et d’autres organes.
La prise en charge ventilatoire est différente selon qu’il s’agit d’un phénotype L ou H. En particulier, le traitement du SDRA associé à une distensibilité pulmonaire normale ou quasi-normale (avec « compliance conservée ») diffère de celui administré dans un SDRA « classique ».
Ce n’est cependant que récemment que les médecins réanimateurs ont fait évoluer les stratégies de ventilation des patients Covid-19. En effet, en mars, les sociétés savantes d’anesthésie et de réanimation ont recommandé de procéder à une intubation précoce des patients présentant un SDRA. Une doctrine principalement dictée par la volonté de ne pas risquer d’exposer les équipes soignantes au virus du fait de l’aérosolisation des particules virales. En effet, un patient intubé, dont la sonde d’intubation est reliée de façon quasi étanche au respirateur, est bien moins susceptible de contaminer le personnel soignant qu’un patient ventilé au masque. Ce risque de transmission aérienne du virus impose donc aux soignants de se protéger en utilisant des masques FFP2, des charlottes, des visières protectrices et des surblouses à manches longues.
« On se rend compte que c’était probablement une erreur d’intuber trop tôt certains patients comme nous l’avons fait au début de l’épidémie. On sait maintenant qu’il faut se retenir d’intuber trop précocement, sauf pour les patients qui étouffent ou qui s’épuisent totalement et qui nécessitent évidemment une intubation en urgence. Aujourd’hui, le message est qu’il faut traiter un patient Covid-19 comme n’importe quel malade de réanimation en utilisant d’abord des techniques habituelles de ventilation non invasive », déclare Damien Barraud. Et le réanimateur d’ajouter : « On a très vite compris, par simple pragmatisme, qu’on n’allait pas pouvoir de toute façon s’en sortir si l’on intubait tous les patients en soins intensifs, tout simplement par manque de respirateurs ».
La prise en charge en soins intensifs a donc logiquement évolué. Aujourd’hui, il n’est donc plus question d’intuber rapidement les malades pour les brancher sous respirateur afin de pallier les problèmes d’oxygénation. En particulier, cette doctrine ne se justifie plus pour les patients présentant un phénotype L, autrement dit pour ceux qui présentent une compliance préservée. Ceux-ci peuvent bénéficier d’une ventilation non invasive avec oxygénation nasale ou au masque, ce qui permet dans le même temps d’éviter la survenue de lésions pulmonaires induites ou aggravées par la ventilation artificielle. En effet, ce mode d’assistance respiratoire entraîne souvent une « surdistension » des territoires correctement aérés. Cette distension exagérée survient lorsque le volume d’air insufflé par le ventilateur est trop important par rapport au volume pulmonaire disponible, ce qui entraîne une déformation importante du tissu pulmonaire ventilé.
Les réanimateurs ont donc fait « machine arrière », en choisissant de ne plus intuber systématiquement les patients Covid-19. Ce faisant, on pourrait éviter la survenue de lésions provoquées par des volumes et des pressions intrapulmonaires trop élevés. « Comme dans un SDRA classique, la ventilation des patients Covid-19 doit être protectrice dans la mesure où elle vise à ne pas provoquer de barotraumatisme », souligne le réanimateur Damien Barraud.
Remise en cause des stratégies initiales de prise en charge
Les médecins ont donc appris au fur et à mesure de la prise en charge des patients présentant un SDRA avec pneumonie hypoxémiante (s’accompagnant d’une hypoxémie). Ils ont actuellement plus de recul, se montrent plus prudents et réalisent aujourd’hui qu’une même stratégie de ventilation ne s’applique pas à tous les patients Covid-19 admis en réanimation. Plus que jamais, ils tiennent compte de l’état clinique du patient (du phénotype), qui peut par ailleurs évoluer. « Tout ce que nous pouvons faire consiste à ‘acheter du temps’ en adaptant au mieux les réglages de la ventilation mécanique en fonction des phénotypes des patients, afin de limiter les lésions associées à la ventilation. Nous devons faire preuve de patience », résume Luciano Gattinoni et ses collègues de Göttingen dans un article publié le 30 mars dans l’American Journal of Respiratory and Critical Care Medicine.
Des réanimateurs américains font aujourd’hui le même constat que leurs collègues allemands confrontés plus tôt à l’épidémie de Covid-19. « La décision d’intuber repose sur le jugement clinique du médecin réanimateur », peut-on lire dans un article publié le 16 avril dans cette même revue. Et de préciser que cette décision est basée sur des facteurs tels que l’hypoxémie, la fréquence respiratoire, les efforts du patient pour respirer.
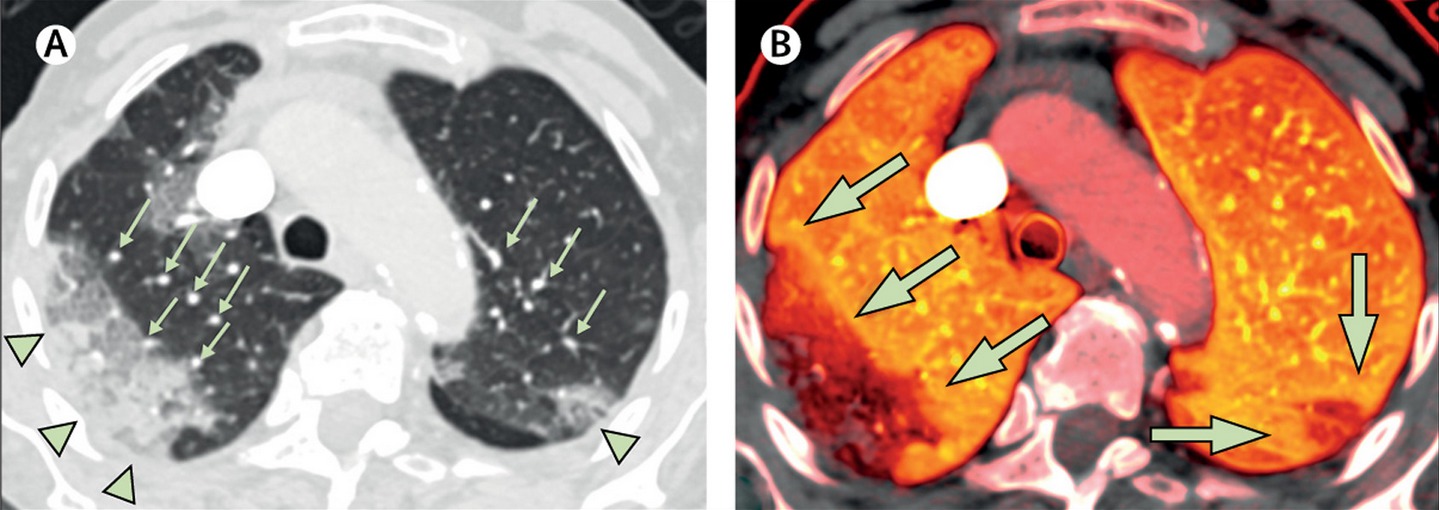
Surprenantes images
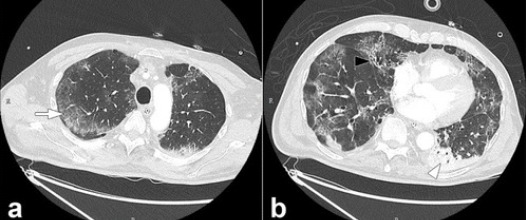
Une équipe américaine a rapporté dans un article publié le 30 avril dernier dans la revue Lancet Infectious Diseases, des résultats jamais rapportés auparavant au sujet de la pneumonie Covid-19. Des radiologues, pneumologues et réanimateurs du Massachusetts General Hospital de Boston (Etats-Unis) ont utilisé une technique d’imagerie, dénommée « tomodensitométrie double énergie » (dual-energy CT) [4] pour mieux caractériser la perfusion pulmonaire dans la maladie Covid-19. Cette technologie permet de reconstruire des images à partir de l’acquisition simultanée à deux niveaux d’énergie différentes.
Chez les trois patients étudiés, aucun micro-caillot pulmonaire n’a été observé. En revanche, les radiologues ont observé d’étonnantes anomalies de perfusion. Outre les images typiques de pneumonie associée au Covid-19, les médecins ont observé la présence de vaisseaux tortueux et dilatés à l’intérieur et aux abords des lésions pulmonaires. Après analyse rétrospective des images de neuf autres patients Covid-19 obtenues par la même technologie, il s’avère que ces malades présentaient ces mêmes anomalies de perfusion.
Plus précisément, les images ont notamment révélé une augmentation de la perfusion sanguine en amont des opacités pulmonaires et une augmentation de la perfusion autour des zones de condensation (image d’un « halo » de perfusion accrue). C’est la première fois que l’on observe dans la pneumonie à SARS-CoV-2 l’association de telles anomalies touchant la vascularisation et la perfusion.
Ces anomalies de perfusion évoquent un shunt intrapulmonaire, autrement dit un décalage (mismatch) entre ventilation et perfusion, qui lui-même favorise la formation de caillots (thromboses). Dans ces zones où les échanges gazeux se font mal, la ventilation est faible ou absente alors que la perfusion est augmentée. La dilatation des vaisseaux pulmonaires pourrait être due au fait que ceux-ci ne se contractent pas comme ils le devraient en réponse à l’hypoxémie, sans doute en raison de l’atteinte endothéliale (paroi interne des vaisseaux sanguins) et de l’inflammation diffuse.
En résumé, ces images, qui ne sont pas typiques d’un SDRA, indiquent que des mécanismes de shunt intrapulmonaire pourraient jouer un rôle central dans l’atteinte pulmonaire du Covid-19, phénomène vasculaire auparavant sous-estimé. Des études évaluant la ventilation et la perfusion pulmonaire par tomodensitométrie double énergie chez un plus grand nombre de patients s’avèrent donc indispensables, estiment les radiologues américains.
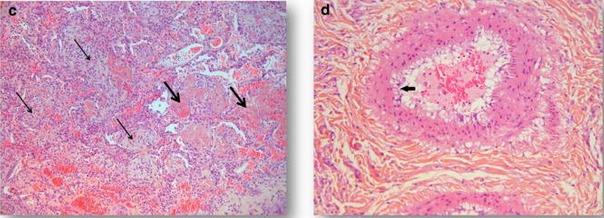
Données histologiques
A ces données cliniques, gazométriques, radiologiques et ventilatoires, viennent s’ajouter des données issues de l’analyse au microscope de poumons provenant de patients Covid-19 décédés. Des biopsies pulmonaires post-mortem ont été réalisées, avec accord des familles, au CHU de Lille, entre début mars et début avril, chez six patients Covid-19 à différents stades de la maladie. Le premier patient présentait un SDRA de phénotype L. Il est décédé à un stade précoce de la maladie, cinq jours après l’apparition de la fièvre. L’examen des tissus pulmonaires a montré une pneumonie lymphocytaire (présence de cellules inflammatoires).
Les cinq autres patients, décédés une vingtaine de jours après le début des symptômes, avaient développé un phénotype de type H. L’examen histologique a montré des dépôts diffus de fibrine (protéine provenant de l’activation de la coagulation) dans les alvéoles. Les anatomopathologistes ont également constaté que les cellules de soutien du tissu pulmonaire (fibroblastes) ont produit un tissu conjonctif lâche dans les conduits alvéolaires menant aux alvéoles et dans les bronchioles. Les chercheurs ont observé dans tous les cas que les amas de fibrine présents dans les alvéoles sont colonisés par des fibroblastes. Des cellules immunitaires sont également présentes. Enfin, il existe une atteinte majeure de l’endothélium vasculaire. En effet, on a observé que les cellules qui tapissent la paroi interne des petits et moyens vaisseaux se détachent.
Cette atteinte histologique diffère de ce que l’on observe habituellement dans un SDRA dans la mesure où l’atteinte diffuse des alvéoles avec accumulation intra-alvéolaire de fibrine peut constituer la lésion histologique prédominante.
Ces lésions histologiques de pneumopathie amènent les médecins-chercheurs à penser à la possibilité d’utiliser des corticoïdes. En effet, les lésions ressemblent beaucoup à celles observées dans une variété de pneumonie caractérisée par sa sensibilité au traitement corticoïde [5]. Cette atteinte pulmonaire caractérisée par la présence d’un matériel obstructif dans les petits conduits pulmonaires dans des cas sévères de pneumonie dans l’infection à SARS-CoV-2 soulève la question de savoir si l’utilisation d’une ventilation avec pression expiratoire positive (PEP) élevée pourrait être délétère. Là encore, ces résultats montrent que le protocole de la ventilation mécanique devrait être ajusté en fonction du phénotype du patient afin de limiter les lésions associées à la ventilation.
Au vu des données les plus récentes, l’atteinte respiratoire dans la maladie Covid-19 est donc loin de se résumer à des anomalies du seul tissu pulmonaire (alvéoles), la vascularisation pulmonaire est également modifiée. Cela ne ressemble pas à ce que l’on observe classiquement dans un SDRA.
À toutes ces anomalies s’ajoutent une hypercoagulabilité qui favorise la formation dans le poumon de micro-caillots sanguins (micro-thrombus), pouvant eux-mêmes contribuer à l’hypoxémie dans les formes sévères de Covid-19. Par ailleurs, certains patients présentent une co-infection bactérienne pulmonaire. Il reste enfin à déterminer si le coronavirus peut, via une action directe sur le système nerveux central, ou indirecte (via des mécanismes inflammatoires), être impliqué dans un dysfonctionnement du contrôle respiratoire.
L’ensemble des données cliniques, radiologiques, histologiques accumulées ces dernières semaines montrent que la compréhension de l’atteinte pulmonaire liée au Covid-19 ne cesse de progresser, parfois à la faveur d’observations cliniques inattendues ou de données surprenantes. Or comprendre les mécanismes physiopathologiques qui sous-tendent la survenue et l’évolution de cette pneumonie s’avère crucial pour décider du traitement le plus approprié pour chaque patient pris en charge en soins intensifs. « En période de crise sanitaire, et peut-être même surtout dans de telles circonstances, il importe de produire des données scientifiques robustes afin de mieux cerner la physiopathologie pulmonaire du Covid19 », insiste le pneumologue Thomas Gille. Et ce d’autant qu’il apparaît de plus en plus clairement qu’au sein des pneumonies hypoxémiantes (avec faible oxygénation dans le sang), celle associée à l’infection au SARS-CoV-2 est véritablement unique.
Marc Gozlan (Suivez-moi sur Twitter, sur Facebook)
[1] Produit par les cellules endothéliales, le monoxyde d’azote (NO) entraine une vasodilatation. L’inhalation de NO dilate les vaisseaux pulmonaires dans les territoires ventilés en redistribuant préférentiellement le débit sanguin vers ces zones. Il améliore ce que les physiologistes appellent le rapport ventilation-perfusion (V/Q).
[2] Contrairement à ce qui se passe dans les autres tissus de l’organisme : la baisse de pression alvéolaire en oxygène provoque localement une constriction des vaisseaux sanguins (vasoconstriction). Ce mécanisme réflexe, unique aux poumons, permet une redistribution préférentielle du débit sanguin vers des zones mieux ventilées afin d’optimiser l’oxygénation sanguine.
[3] La détérioration clinique peut notamment être due à la sévérité de la maladie (aggravation de l’œdème pulmonaire du fait de l’infection virale responsable d’une augmentation de la perméabilité des vaisseaux sanguins, d’une surinfection bactérienne, de lésions PSILI pulmonaires que s’auto-infligent les patients sous ventilation (Patient Self-Inflicted Lung Injury) du fait des efforts importants importants, d’une insuffisance cardiaque, d’une défaillance multi-viscérale (dysfonctionnement de plusieurs organes), ou encore à l’association de tous ces facteurs.
[4] La tomodensitométrie à double énergie est également appelée scanner spectral.
[5] L’examen histologique a montré une pneumopathie organisée fibrineuse aiguë (Acute Fibrinous and Organizing Pneumonia ou AFOP). L’accumulation intra-alvéolaire de fibrine résulte de l’activation des facteurs de coagulation.
Pour en savoir plus :
Alhazzani W, Møller MH, Arabi YM, Loeb M, Gong MN, Fan E, Oczkowski S, Levy MM, Derde L, Dzierba A, Du B, Aboodi M, Wunsch H, Cecconi M, Koh Y, Chertow DS, Maitland K, Alshamsi F, Belley-Cote E, Greco M, Laundy M, Morgan JS, Kesecioglu J, McGeer A, Mermel L, Mammen MJ, Alexander PE, Arrington A, Centofanti JE, Citerio G, Baw B, Memish ZA, Hammond N, Hayden FG, Evans L, Rhodes A. Surviving Sepsis Campaign: Guidelines on the Management of Critically Ill Adults with Coronavirus Disease 2019 (COVID-19). Crit Care Med. 2020 Mar 27. doi: 10.1097/CCM.0000000000004363
Copin MC, Parmentier E, Duburcq T, Poissy J, Mathieu D; Lille COVID-19 ICU and Anatomopathology Group. Time to consider histologic pattern of lung injury to treat critically ill patients with COVID-19 infection. Intensive Care Med. 2020 Apr 23. doi: 10.1007/s00134-020-06057-8
Gattinoni L, Chiumello D, Caironi P, Busana M, Romitti F, Brazzi L, Camporota L. COVID-19 pneumonia: different respiratory treatments for different phenotypes? Intensive Care Med. 2020 Apr 14. doi: 10.1007/s00134-020-06033-2
Gattinoni L, Coppola S, Cressoni M, Busana M, Rossi S, Chiumello D.Covid-19 Does Not Lead to a « Typical » Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med. 2020 Mar 30. doi: 10.1164/rccm.202003-0817LE
Griffin KM, Karas MG, Ivascu NS, Lief L. Hospital Preparedness for COVID-19: A Practical Guide from a Critical Care Perspective. Am J Respir Crit Care Med. 2020 Apr 16. doi: 10.1164/rccm.202004-1037CP
Kashani KB. Hypoxia in COVID-19: Sign of Severity or Cause for Poor Outcomes. Mayo Clin Proc. 2020 Apr 23doi: 10.1016/j.mayocp.2020.04.021
Krähenbühl M, Oddo M, Piquilloud L, Pantet O. Covid-19 : Prise en charges aux soins intensifs. Rev Med Suisse. 2020 Apr 29;16(N° 691-2):863-868. PMID:32348055
Lang M, Som A, Mendoza DP, Flores EJ, Reid N, Carey D, Li MD, Witkin A, Rodriguez-Lopez JM, Shepard J-A, Little BP. Hypoxaemia related to COVID-19: vascular and perfusion abnormalities on dual-energy CT. Lancet Infect Dis. Published:April 30, 2020. doi: 10.1016/S1473-3099(20)30367-4
Marini JJ, Gattinoni L. Management of COVID-19 Respiratory Distress. JAMA. 2020 Apr 24. doi: 10.1001/jama.2020.6825
Möhlenkamp S, Thiele H. Ventilation of COVID-19 patients in intensive care units. Herz. 2020 Apr 20. doi: 10.1007/s00059-020-04923-1
Pan C, Chen L, Lu C, Zhang W, Xia JA, Sklar MC, Du B, Brochard L, Qiu H. Lung Recruitability in SARS-CoV-2 Associated Acute Respiratory Distress Syndrome: A Single-center, Observational Study. Am J Respir Crit Care Med. 2020 Mar 23. doi: 10.1164/rccm.202003-0527LE
Schultz MJ. High versus low PEEP in non-recruitable collapsed lung tissue: possible implications for patients with COVID-19. Lancet Respir Med. 2020 Apr 20. pii: S2213-2600(20)30180-6. doi: 10.1016/S2213-2600(20)30180-6
Tobin MJ. Basing Respiratory Management of Coronavirus on Physiological Principles. Am J Respir Crit Care Med. 2020 Apr 13. doi: 10.1164/rccm.202004-1076ED
